Nobel Kimya Ödülü
DNA Onarım Mekanizmalarını Keşfedenlerin Oldu
Dünya üzerinde yaşamın devamlılığı, canlıları canlı yapan tüm özellikleri kodlar halinde barındıran genetik bilginin nesilden nesile aktarılabilmesi sayesinde mümkün. Bu yüzden de genetik bilgiyi içinde saklayan DNA molekülünün bütünlüğünü koruması ve bozulmalara karşı dayanıklı olması çok önemli. Aslında DNA sürekli olarak çevresel etmenlerin saldırısı altındadır ve yapısında oluşan hasarlar onarılmadığı takdirde mutasyonlar ve belki de bunlara bağlı hastalıklar ortaya çıkar. Neyse ki hücrelerimiz DNA’nın yapısında oluşan bozulmaları sıkı şekilde takip eden ve gerekli düzeltmeleri yapan bir dizi mekanizmaya sahiptir. Bu yılın Nobel Kimya Ödülü’nü işte bu mekanizmalar konusunda en önemli keşifleri yapan üç bilim insanı kazandı. Bu yılki ödüller ilk defa bir Türk’ün bilim alanında Nobel kazanmasıyla ülkemiz için ayrıca gurur ve sevinç kaynağı oldu.

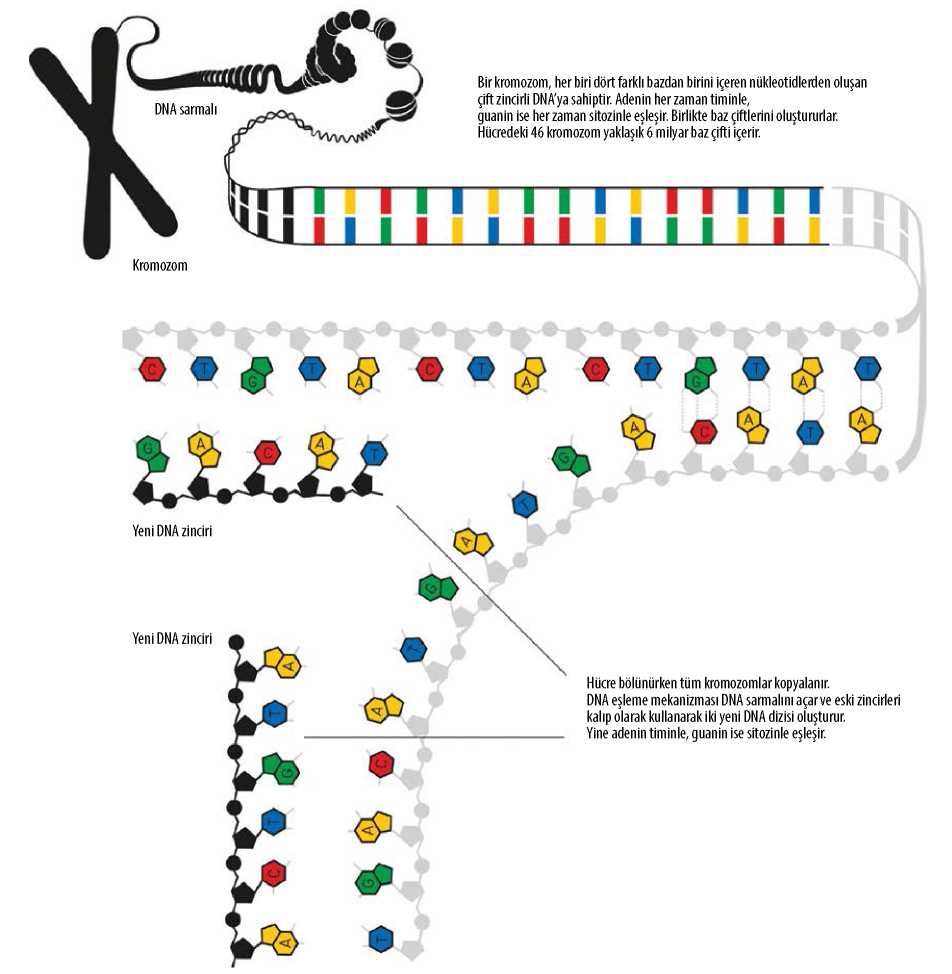
Bizi biz yapan genetik bilgi yüz binlerce yıldır hücreden hücreye, nesilden nesile aktarılarak bugüne ulaştı. Bu bilgi çevreden gelen pek çok saldırının tehdidi altında olsa da şaşırtıcı biçimde bütünlüğünü koruyabiliyor. Bu yılın Nobel Kimya Ödülü’ne hücrelerin DNA’yı nasıl onardığını ve dolayısıyla genetik bilgiyi nasıl koruduğunu açıklayan ve betimleyen Tomas Lindahl, Paul Modrich ve Aziz Sancar layık görüldü.
Kim olduğunuz, bir spermden gelen 23 kromozom ile bir yumurtadan gelen 23 kromozom birleştiği zaman belirlenmişti. Bu ikisi birlikte genomunuzun orijinal versiyonunu yani genetik materyalinizi oluşturmuştu. Oluşmanız için gerekli tüm genetik bilgi o birleşimde mevcuttu. Eğer biri bu ilk hücredeki DNA moleküllerini alıp uzatacak olsa moleküllerin boyu toplamda iki metreyi bulurdu.
Daha sonra döllenen yumurta bölündüğünde DNA molekülleri kopyalanmış ve yavru hücreler de birer tam kromozom takımı edinmiş oldu. Sonra hücreler tekrar bölündü; ikiyken dört, dörtken sekiz oldular. İlk haftanın sonunda, her biri kendi genetik materyal takımına sahip 128 hücreden oluşuyordunuz. DNA’nızın toplam uzunluğuysa 300 metreye yaklaşıyordu.
Bugün -milyarlarca ve milyarlarca hücre bölünmesi sonrasında- DNA’nız alınıp uzatılsa Güneş ve Dünya arasında yaklaşık 250 kez gidip gelebilecek uzunlukta olur. Genetik materyaliniz bu kadar çok kez kopyalanmış olmasına rağmen en son oluşturulan kopya döllenen yumurtadaki orijinale şaşırtıcı derecede benzerdir. İşte yaşamın molekülleri azametini burada gösterir, çünkü kimyasal açıdan bunun imkânsız olması gerekirdi. Tüm kimyasal süreçler rastgele hatalara açıktır. Üstelik DNA’nız günlük olarak zararlı ışımaların ve reaktif (kolayca tepkimeye girebilen) moleküllerin etkilerine maruz kalır. Aslında bu durumda daha bir fetüs haline gelmeden çok önce kimyasal bir kaosa dönüşmüş olmanız gerekirdi.
DNA’mız Bir Protein Sürüsü Tarafından Denetlenir
DNA’mız birtakım onarım mekanizmaları sayesinde yıllar sonra bile bütünlüğünü şaşırtıcı biçimde korur: Bir protein sürüsü genleri denetler. Bu proteinler genomu sürekli denetler ve oluşan herhangi bir hasarı onarır. 2015 Nobel Kimya Ödülü bu temel süreçleri moleküler düzeyde açıklamayı başaran üç bilim insanına verilecek. Bu üç bilim insanının sistematik çalışmaları canlı hücrenin işleyişine yönelik anlayışımıza belirleyici bir katkıda bulunduğu gibi kalıtsal hastalıkların moleküler nedenleri ile hem kanserin hem de yaşlanmanın altında yatan mekanizmalar hakkında bilgi edinmemizi sağladı.
Tomas Lindahl, Paul Modrich ve Aziz Sancar birbirlerinden bağımsız olarak, insanlarda DNA onarımı sırasında gerçekleşen birkaç süreci açıklamayı başardı. Hikaye Alfred Nobel’le aynı ülkede doğmuş olan Tomas Lindahl ile başlıyor.
Yaşam Devam Ediyor O Halde DNA Onarılabilir Olmalı
Tomas Lindahl 1960’ların sonunda “DNA gerçekte ne kadar kararlı?” sorusuna odaklandı. O dönemde bilim camiası yaşamın temeli olan DNA molekülünün aşırı derecede dayanıklı olduğunu düşünüyordu; başka bir ihtimal söz konusu bile edilemezdi. Yeryüzündeki canlıların çeşitlenmesi ve farklı türlerin oluşması mutasyonları gerektiriyordu ancak nesil başına sınırlı sayıda mutasyon yeterliydi. Genetik bilgi fazla dayanıksız olsaydı çok hücreli canlılar var olamazdı. Thomas Lindahl ABD’deki Princeton Üniversitesi’nde yaptığı doktora sonrası çalışmasında DNA’nın moleküler bir kuzeni olan RNA molekülü üzerinde çalışıyordu. Ama işler pek iyi gitmiyordu. Yaptığı deneyde RNA’yı ısıtması gerekiyordu, ancak bu, molekülün engellenemez biçimde parçalanmasına neden oluyordu. RNA’nın DNA’dan daha hassas olduğu iyi biliniyordu, ancak yine de RNA ısıya maruz kaldığında bu kadar hızla yok oluyorsa DNA moleküllerinin yaşam boyu sağlam kalması mümkün müydü? Bu soru Lindahl’ın kafasında yer etti.
Bu soruya cevap aramaya başlaması birkaç yıl sonrasını bulacak, o sırada da İsveç’e, Stockholm’deki Karolinska Enstitüsü’ne dönmüş olacaktı. Dolaysız birkaç deney sonucunda şüphelerinde haklı olduğunu gördü: DNA yavaş ancak dikkat çekici biçimde yıkıma uğruyordu. Lindahl genomun her gün binlerce yıkıcı yaralanmaya uğradığını tahmin ediyordu, buysa insanın Dünya üzerindeki varlığıyla tutarsız bir durumdu. Lindahl tüm bu DNA bozulmalarını onaran moleküler sistemler olduğu sonucuna vardı ve bu düşüncesiyle tamamen yeni bir araştırma alanının kapılarını araladı.
DNA (ve kuzeni RNA) ile ilgili araştırmalar şimdiye kadar 8 kez Nobel kazandırmış oldu:
- 1962 DNA’nın yapısını keşiflerinden dolayı Francis Crick, James Watson ve Maurice Wilkins’e verilen ödül en meşhuru.
- 1980 Rekombinant DNA’nın geliştirilmesi
- (farklı kaynaklardan DNA moleküllerinin yapay olarak bir araya getirilmesiyle oluşan DNA molekülü)
- 1989 RNA’nın tepkimelerde nasıl katalizör görevi yaptığının açıklanması
- 2001 Hücre bölünmesinin mekanizmalarının açıklanması
- 2002 Programlı hücre ölümünün açıklanması
- 2006 RNA girişiminin (RNAi) açıklanması
- 2009 Ribozomların proteinleri nasıl sentezlediğinin açıklanması
- 2015 DNA onarım mekanizmalarının açıklanması
Özel Enzimler DNA Hasarını Gideriyor
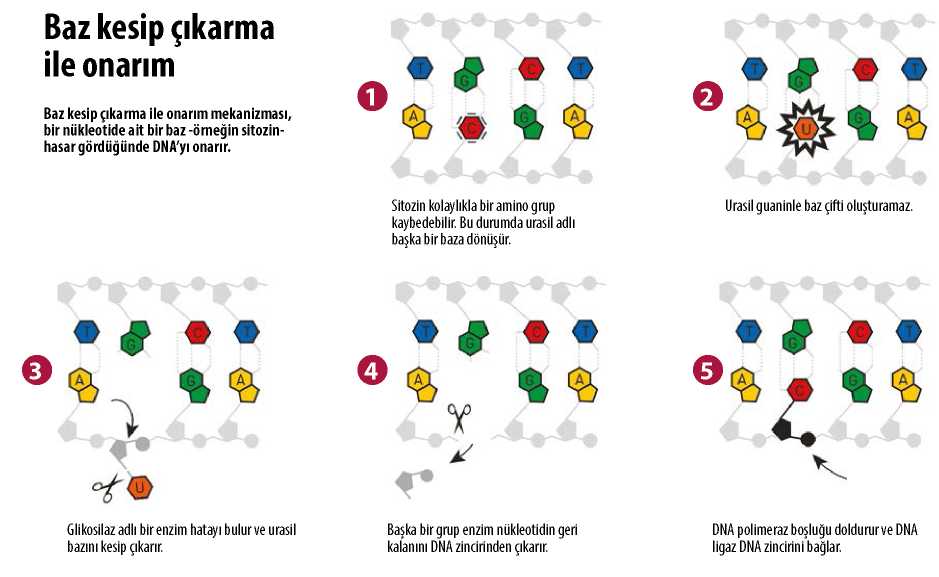
Lindahl, tıpkı insan DNA’sı gibi her biri ade-nin (A), guanin (G), sitozin (C) ve timin (T) bazlarından birini içeren nükleotidlerin, yani yapıtaşlarının bir araya gelmesiyle oluşan bakteri DNA’sını kullanarak onarım enzimlerini aramaya başladı. DNA’nın kimyasal zayıflıklarından biri sitozinin kolayca bir amino grup kaybetmesidir, buysa genetik bilginin değişmesine yol açabilir. DNA’nın ikili sarmal yapısında sitozin her zaman guanin ile eşleşir, ancak amino grubu kaybolursa geride kalan hasarlı kısım adeninle eşleşme eğilimi gösterir. Dolayısıyla eğer bu bozukluğun öylece kalmasına izin verilirse DNA’nın bir sonraki kopyalanması sırasında bir mutasyon oluşur. Lindahl hücrenin buna karşı bir koruma sistemine sahip olması gerektiğini fark etti ve hasarlı sitozin kalıntılarını DNA’dan uzaklaştıran bakteriyel bir enzim tespit etti. 1974’te bulgularını yayımladı.
Tomas Lindahl Baz Kesip Çıkarma ile Onarım Mekanizmasını Çözümlüyor

Bu, Tomas Lindahl’ın hücrenin DNA onarımı-na yönelik alet çantasındaki proteinlerin pek çoğunu bulup incelediği 35 yıllık başarılı bir çalışma döneminin başlangıcı oldu. 1980’lerin başlarında İngiltere’ye gitti ve Londra’daki Imperial Cancer Research Fund’da (Kraliyet Kanser Araştırma Fonu) bir iş buldu. 1986’da yeni kurulan ve sonraları bilimsel yaratıcılıkla adını duyuracak olan Clare Hall Laboratuvarı’nın başına geçti. Lindahl baz kesip çıkarma ile onarımın moleküler şemasını adım adım ortaya çıkardı. Bu mekanizmada Lindahl’ın 1974’te keşfettiğine benzeyen glikosilaz adlı enzimler, DNA
onarım sürecinin ilk basamağında görev alıyor. Baz kesip çıkarma ile onarım, insanlarda da gerçekleşiyor ve Tomas Lindahl 1996’da insandaki onarım sürecini in vitro olarak, yani canlı organizma dışında deneysel düzenekler kullanarak gerçekleştirmeyi başardı.
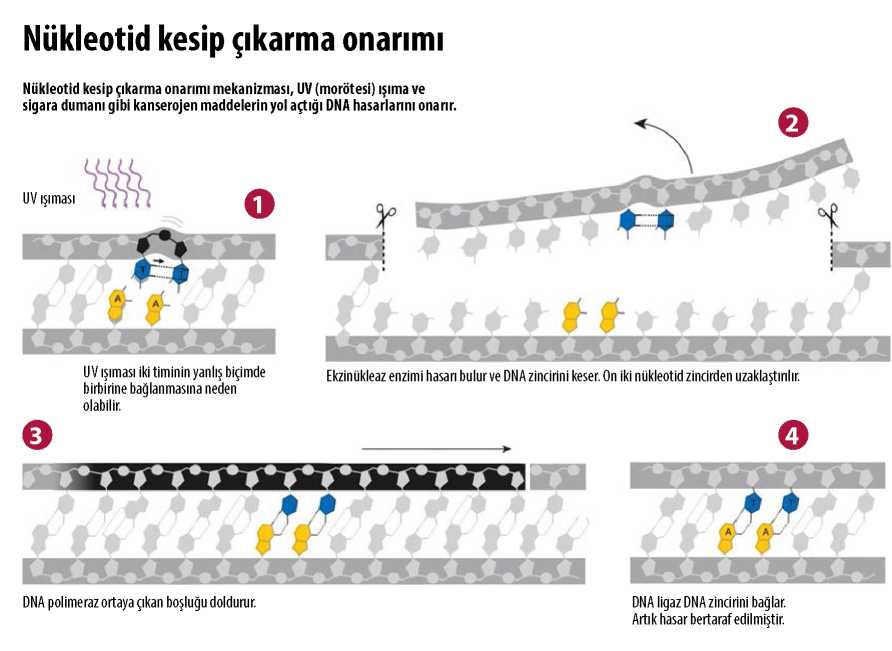
Tomas Lindahl için belirleyici etmen, DNA’nın hücrenin koruyucu ortamında bulunduğunda bile kaçınılmaz olarak değişim geçirdiğini fark etmesi olmuştu. Ancak DNA’nın UV (morötesi) ışıma gibi çeşitli çevresel etmenler etkisiyle hasar görebildiği uzun süredir biliniyordu. İşte hücrelerin çoğunluğunun UV hasarını onarmak için kullandığı mekanizma, Türkiye’deki Savur kasabasında doğmuş ve aktif profesyonel hayatını ABD’de geçirmiş olan Aziz Sancar tarafından betimlendi.
Yaşam İçin İlaç Gibi Biyokimya Süreçleri Nasıl Onardığını Araştırıyor
Aziz Sancar’ın yaşamın moleküllerine olan hayranlığı İstanbul’da tıp okurken başladı. Mezuniyetinin ardından birkaç yıl ABD’de araştırma yaptıktan sonra yurda geri dönüp memleketi olan Savurda hekimlik yaptı. Daha sonra biyokimya eğitimi almak istedi. İlgisi özellikle belirli bir olguya odaklanmıştı: Bakteriler öldürücü dozda UV’ye maruz kaldıktan sonra mavi ışıkla aydınlatıldıklarında birden iyileşiyorlardı. Sancar bu sihir gibi etkiyi çok merak ediyordu; acaba bu etki kimyasal olarak nasıl gerçekleşiyordu?
ABD’li Claud Rupert bu olguyla ilgili çalışmalar yapmıştı. Aziz Sancar da Dallas’taki Texas Üniversitesi’nde Rupert’in laboratuvarında çalışmaya başladı. 1976’da o zamanki kısıtlı moleküler biyoloji imkânlarını kullanarak UV hasarlı DNA’yı onaran fotoliyaz enzimini kodlayan geni klonlamayı, yani genomdan ayrı olarak elde etmeyi, ayrıca bakterinin bu enzimi fazladan üretmesini sağlamayı başardı. Bu çalışma doktora tezi oldu ancak pek de etkili olduğu söylenemezdi; üç doktora sonrası iş başvurusunun üçü de reddedildi. Fotoliyazla ilgili çalışmalarını rafa kaldırmak zorunda kaldı. Aziz Sancar DNA onarımı ile ilgili çalışmalarına devam edebilmek için alanın önde gelen kurumlarından Yale Üniversitesi Tıp Okulu’nda laboratuvar teknisyeni olarak iş buldu. Burada sonunda kendisine Nobel Ödülü kazandıracak olan çalışmalarına başladı.
Aziz Sancar Hücrelerin UV Hasarını Nasıl Onardığını Araştırıyor
O dönemde bakterilerin UV hasarını onarmak için iki sisteme sahip olduğu açıkça biliniyordu: Işığa bağımlı fotoliyaza ek olarak karanlıkta işleyen ikinci bir sistem keşfedilmişti. Aziz Sancar’ın Yale’deki yeni çalışma arkadaşları bu karanlık sistemi, UV’ye hassas olan ve farklı genetik mutasyonlar (uv-rA, uvrB ve uvrC) taşıyan üç bakteri soyunu kullanarak 1960’ların ortalarından beri inceliyordu.

Sancar daha önce fotoliyaz üzerinde yaptığı incelemelere benzer şekilde karanlık sistemin moleküler işleyişini araştırmaya başladı. Birkaç yıl içinde uvrA, uvrB ve uvrC genlerinin kodladığı enzimleri belirlemeyi, izole etmeyi ve karakterize etmeyi başardı. Çığır açıcı in vitro deneylerde bu enzimlerin bir UV hasarını tespit edip DNA zincirinde hasarın her iki tarafında birer kesim yapabildiğini gösterdi. Sonuçta ortaya çıkan 12-13 nükleotid uzunluğundaki parçaysa ortamdan uzaklaştırılıyordu.
UV Hasarı Onarımı İçin İnsanlarda ve Bakterilerde Benzer Mekanizmalar
Aziz Sancar’ın sürecin moleküler ayrıntıları hakkında bilgi üretme yeteneği araştırma alanını tümden değiştirdi. Bulgularını 1983’te yayımladı. Başarıları Chapel Hill’deki North Carolina Üniversitesi’nden biyokimya alanında doçentlik teklifi almasını sağladı. Orada da nükleotid kesip çıkarma onarımının sonraki aşamalarını yine aynı hassasiyetle ortaya çıkardı. Sancar, aralarında Tomas Lindahl’ın da bulunduğu başka araştırmacılarla paralel olarak bu onarımın insanlarda gerçekleşen versiyonunu araştırdı. UV hasarını insan DNA’sından kesip çıkaran moleküler düzenek bakterideki karşılığından çok daha karmaşık, ancak nükleotid kesip çıkarma onarımı kimyasal anlamda tüm organizmalarda benzer şekilde işliyor.
Peki Sancar’ın fotoliyaza yönelik başlangıçtaki ilgisine ne oldu? Sonunda bu enzime geri döndü ve bakterilerin iyileşmesini sağlayan mekanizmayı açıklığa kavuşturdu. Ayrıca fotoliyazın insanda bulunan bir karşılığının, kirkadyan saati adı verilen biyolojik vücut saatinin işlemesinde rol oynadığının gösterilmesine yardım etti.
Şimdi de sıra Paul Modrich’in çalışmalarına geldi. O da yine bir onarım mekanizması hakkında muğlak bir fikirle başladığı çalışmaları sonucunda mekanizmayı mükemmel moleküler ayrıntılarıyla ortaya çıkardı.
Şu “DNA Ivır Zıvırını” Öğrenmeye Değdi
Paul Modrich ABD’de, New Mexico’daki küçük bir kasabada büyüdü. Engin arazilerdeki biyolojik çeşitlilik onda doğaya karşı bir ilgi uyandırmıştı. Ancak biyoloji öğretmeni olan babası bir gün şöyle dedi: “Şu DNA ıvır zıvırını öğrensen iyi olur.” Sene 1963’tü, yani James Watson ve Francis Crick DNA’nın yapısını keşfettikleri için Nobel Ödülü kazandıktan bir yıl sonra.
Birkaç yıl sonra “DNA ıvır zıvırı” gerçekten de Paul Modrich’in hayatının merkezine yerleşmişti. Araştırma kariyerinin başlarında Stanford Üniversitesi’nde doktora öğrencisiyken, daha sonra Harvard’da doktora sonrası araştırmacıyken ve Duke Üniversitesi’nde yardımcı doçentken DNA’yı etkileyen bir dizi enzim üzerinde çalıştı: DNA ligaz, DNA polimeraz ve bir restriksiyon enzimi (DNA’yı spesifik bir bölgesinden kesen enzim) olan Eco R I. Sonunda, 1970’lerin sonlarına doğru dikkatini Dam metilaz adlı enzime yönelttiğinde “DNA ıvır zıvırının”, araştırma kariyerinin büyük bir kısmı boyunca kendisini meşgul edecek başka bir kısmına rastladı.
İki Araştırma Süreci İç İçe Geçiyor
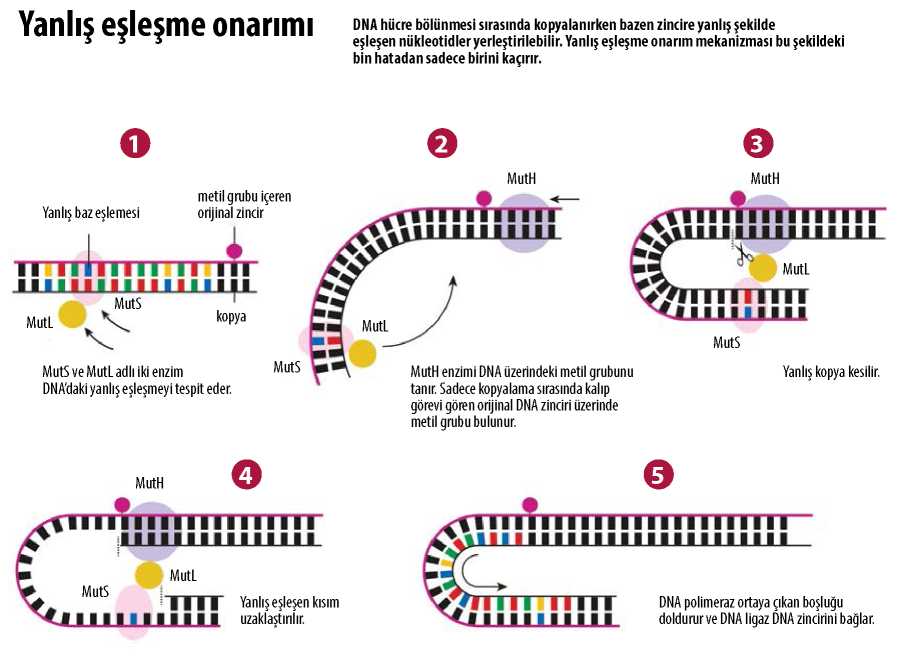
Dam metilaz DNA’ya metil grupları bağlar. Paul Modrich bu metil gruplarının işaret levhaları gibi işlev görerek belirli bir restriksiyon enziminin DNA zincirini doğru bölgeden kesmesine yardımcı olabildiğini gösterdi. Ancak bundan sadece birkaç yıl sonra Harvard Üniversitesi’nden Matthew Meselson adlı moleküler biyolog DNA’daki metil grupları için farklı bir işaretleme işlevi öne sürmüştü.
Meselson moleküler biyoloji sanatını konuşturup DNA’sında birkaç yanlış baz eşleşmesi bulunan bir bakteriyel virüs oluşturmuştu. Örneğin A, T yerine C’yle eşleşmiş halde bulunabiliyordu. Bu virüslerin bakterileri enfekte etmesine izin verdiğinde bakteriler bu yanlış eşleşmeleri düzeltiyordu. Bakterinin böyle bir işlevi neden geliştirmiş olabileceğini kimse bilmiyordu, ancak 1976’da Meselson bunun DNA eşlenirken, yani kopyalanırken zaman zaman oluşan yanlış eşleştirmeleri düzelten bir onarım mekanizması olabileceğini ihtimali üzerinde durdu. Eğer durum böyleyse belki de DNA üzerindeki metil grupları, düzeltme sırasında bakterinin hangi zinciri doğru bilgiyi içeren kalıp olarak kullanacağını belirlemesine yardımcı oluyordu. Yeni zincir, yani hatalı kopya hâlâ metillenmemiş durumdayken bu belki de onun tanınmasını ve düzeltilmesini sağlayan şeydi.
İşte burada, DNA’nın metillenmesi konusunda Paul Modrich ve Matthew Meselson’ın yolları kesişti. Birlikte çalışarak DNA’sında birkaç yanlış eşleşme bulunan bir virüs oluşturdular. Bu defa Modrich’in dam metilazı da DNA zincirlerinden birine metil grupları eklemek için kullanılmıştı. Bu virüsler bakterileri enfekte ettiği zaman bakteriler tutarlı biçimde metil grubu olmayan zincirleri düzeltiyordu. Mod-rich ile Meselson DNA yanlış eşleşme onanmınm DNA kopyalanırken oluşan yanlış eşleşmeleri düzelten, bozuk zinciriyse metillenmemiş olmasından tanıyan doğal bir süreç olduğu sonucuna vardı.
Paul Modrich DNA Yanlış Eşleşme Onarımını Betimliyor
Bu keşif Paul Modrich için, yanlış eşleşme onarım sürecindeki enzimlerin birbiri ardına klonlanıp haritalandığı on yıllık sistematik bir çalışmayı başlattı. 1980’lerin sonuna doğru bu karmaşık moleküler onarım mekanizmasını in vitro olarak oluşturup çok ayrıntılı şekilde incelemeyi başarmıştı. Bu çalışması 1989’da yayımlandı.

Tıpkı Lindahl ve Sancar gibi Modrich de onarım sisteminin insandaki veris-yonunu da inceledi. Bugün biliyoruz ki yanlış eşleşme onarım mekanizması insan genomu kopyalanırken oluşan her bin hatadan sadece birini kaçıracak kadar etkin işliyor. Ancak insandaki yanlış eşleşme onarımında orijinal zincirin nasıl belirlendiğini hâlâ kesin olarak bilemiyoruz. DNA metillenmesinin genomumuzda bakteride olduğundan farklı işlevleri var, dolayısıyla hangi zincirin düzeltileceğini belirleyen başka bir şey olması lazım. İşte bu hâlâ gizemini koruyor.
Onarım Sistemindeki Bozukluklar Kansere Yol Açıyor
Baz kesip çıkarma, nükleotid kesip çıkarma ve yanlış eşleşme onarımlarının yanı sıra DNA’mızı koruyan başka mekanizmalar da var. Bu mekanizmalar her gün güneş ışınlarının, sigara dumanının ya da genler üzerinde tahribat yaratan başka maddelerin neden olduğu binlerce DNA hasarını onarıyor; DNA üzerindeki anlık değişimleri sürekli bertaraf ediyor. Ayrıca her hücre bölünmesinde yanlış eşleşme onarımıyla birkaç bin yanlış eşleşme düzeltiliyor. Bu onarım mekanizmaları olmasa genomumuz yıkıma uğrardı. Öte yandan sadece bir bileşen bile görevini yapamadığında genetik bilgi hızla değişir ve kanser riski artar. Örneğin nükleotit kesip çıkarma onarım sürecindeki doğuştan gelen bozukluklar xeroderma pigmentosum adı verilen bir hastalığa neden olur. Xeroderma pigmentosum hastaları UV ışımasına karşı aşırı derecede hassastır ve güneş ışınlarına maruz kaldıklarında cilt kanserine yakalanırlar. DNA yanlış eşleşme onarımındaki bozukluklarsa kalıtsal kolon kanseri riskini artırır.
Aslında pek çok kanser türünde bu onarım sistemlerinin bir ya da birden fazlası tamamen ya da kısmen etkisiz haldedir. Bu da kanser hücrelerinin DNA’sını normal hücrelere göre daha kararsız yapar,
kanser hücrelerinin sıkça mutasyon geçirip kemote-rapiye direnç geliştirmesinin bir nedeni budur. Aynı zamanda bu hasta hücreler hâlâ işlemekte olan onarım sistemlerine daha fazla bağımlıdır; bunlar olmadan DNA’ları çok fazla zarar görür ve hücreler ölür. Araştırmacılar kanser hücrelerinin bu zayıflığını yeni kanser ilaçları geliştirmek için kullanmaya çalışıyor. Kanser hücrelerinde sağlam kalan onarım sistemlerinden birini engellemek kanserin büyümesini durdurmalarını ya da yavaşlatmalarını sağlıyor. Ola-parib kanser hücrelerinde bir onarım sistemini engelleyen ilaç etken maddelerine bir örnek.
Sonuç olarak 2015 Nobel Kimya Ödülü’ne layık görülen üç bilim insanının yaptığı temel araştırmalar sadece biyolojik işleyişimize ilişkin bilgimizi derinleştirmekle kalmayıp aynı zamanda hayat kurtaran tedavilerin geliştirilmesine önayak oldu. Paul Modrich’in deyişiyle “Merak temelli araştırma işte bu yüzden önemli. Sizi nereye götüreceğini asla bilemezsiniz… Biraz da şansınız varsa, ne âlâ.”










Social Profiles